Полоний и ливерморий
Открытие полония. Элемент № 84, полоний — первый элемент, вписанный в таблицу
Менделеева после открытия радиоактивности. Он же первый (по порядку
атомных номеров) и самый лёгкий из элементов, не имеющих
стабильных изотопов. Он же один из первых радиоактивных элементов,
применённых в космических исследованиях. В то же время элемент №
84, пожалуй, один из наименее известных, наименее популярных радиоактивных
элементов. Вначале он остался в тени, оттеснённый на второй план
славой радия. Позже его не слишком афишировали, как почти все материалы
атомных и космических исследований. Широкую известность полоний получил в
ноябре 2006 года, после смерти в Лондоне перебежчика Литвиненко от полония-210.
Мало кто помнит, что этот элемент предсказал
Д.И. Менделеев. Наряду с экабором (галлием), экаалюминием (скандием)
и экасилицием (германием) он упомянул в 1870 году
существование аналога теллура, а в 1889 году уточнил свойства элемента
с порядковым номером 84. Менделеев назвал его двителлуром (на
санскрите — „второй теллур“) и предположил, что атомная масса нового
элемента будет близка к 212. Конечно, Менделеев не мог предвидеть,
что этот элемент окажется неустойчивым.
Полоний — первый радиоактивный элемент, открытый
в 1898 году супругами Кюри, которые искали источник радиоактивности
в некоторых минералах, — они излучали сильнее, чем чистый уран. Мадам
Кюри тестировала одно вещество за другим — все, которые только могла
достать, одолжить в химических лабораториях, выпросить
в минералогических музеях (впоследствии она не только аккуратно
возвратила образцы владельцам, но и выразила им благодарность
в своей публикации). Из всех веществ, не содержащих уран,
активными были только соединения тория. Когда оказалось, что сильную активность
проявляет урановая смоляная руда (в основном — оксид U3O8),
Мария Кюри решила выделить из неё химическим путём новый радиоактивный
элемент. До этого было известно только два слабо радиоактивных химических
элемента — уран и торий. Опыты были начаты с традиционного
качественного анализа минерала по схеме, которую предложил немецкий
химик-аналитик К.Р. Фрезениус ещё в 1841 году
и по которой многие поколения студентов в течение почти полутора
веков определяли катионы так называемым сероводородным методом. Вначале
у неё было около 100 г минерала; затем американские геологи
подарили Пьеру Кюри ещё
Незадолго до этого Пьер сконструировал электрометр,
который точно измерял очень малые токи, в триллионные доли ампера —
пикоамперы. В приборе использовался открытый им вместе с братом
Жаком пьезоэлектрический эффект — появление на гранях некоторых
кристаллов при их сдавливании электрических зарядов (этот эффект
сегодня применяют, например, в кварцевых часах, в пьезозажигалках).
Дозируя давление на кристалл, можно было компенсировать и таким
образом измерять очень малые токи. Конструкция состояла из двух
расположенных горизонтально с небольшим зазором металлических дисков,
на которые подавали напряжение около 100 В. Если между дисками находился
только слой воздуха, тока не было. Но когда на нижний диск
насыпали тонким слоем определённое количество какого-либо соединения урана,
воздух, ионизованный „урановыми лучами“, становился проводником. При этом
между дисками протекал очень слабый ток, который можно было измерить
и определить мощность излучения.
Марии Кюри помогал один из руководителей химического
практикума в Школе физики и промышленной химии Густав Бемон. Прежде
всего минерал был растворён в азотной кислоте. Затем жидкость выпарили
досуха, остаток растворили в воде и пропустили через раствор ток
сероводорода. При этом выпал чёрный осадок, который мог содержать
нерастворимые сульфиды свинца, висмута, меди, мышьяка, сурьмы и некоторых
других металлов. Хотя уран и торий остались в растворе, осадок был
радиоактивным. Мария Кюри обработала его сульфидом аммония, чтобы отделить
мышьяк и сурьму, — они в этих условиях образуют растворимые
тиосоли, например (NH4)3AsS4 и (NH4)3SbS3.
Раствор не обнаружил радиоактивности и был отброшен. В осадке
остались сульфиды свинца, висмута и меди. Его снова растворили
в азотной кислоте, добавили к раствору серную кислоту и выпарили
на пламени горелки до появления густых белых паров SO3.
При этом летучая азотная кислота полностью удаляется, а нитраты
металлов превращаются в сульфаты. После охлаждения смеси и добавления
холодной воды в осадке оказался нерастворимый сульфат свинца PbSO4
— активности в нём не было. К отфильтрованному раствору добавили
крепкий раствор аммиака. Опять выпал осадок, на этот раз белого цвета;
он содержал смесь основного сульфата висмута (BiO)2SO4
и гидроксида висмута Bi(OH)3. В растворе же остался комплексный
аммиакат меди [Cu(NH3)4]SO4 ярко-синего цвета.
Белый осадок, в отличие от раствора, оказался сильно радиоактивным.
Поскольку свинец и медь были уже отделены, в нём остались висмут
и примесь нового элемента.
Мария Кюри снова перевела белый осадок в тёмно-коричневый
сульфид Bi2S3, высушила его и нагрела
в вакуумированной ампуле. Сульфид висмута при этом не изменился
(он устойчив к нагреву и лишь при 685°С плавится), однако
из осадка выделились какие-то пары, которые осели в виде чёрной плёнки
на холодной части ампулы. Плёнка была сильно радиоактивной
и, очевидно, содержала новый химический элемент — сосед висмута
в периодической таблице. Это и был полоний — следующий
после урана и тория радиоактивный элемент, вписанный в Периодическую
таблицу (в том же 1898 году были открыты радий, а также группа
благородных газов — неон, криптон и ксенон). Как потом выяснилось,
полоний при нагревании легко возгоняется — его летучесть примерно
такая же, как у цинка.
Супруги Кюри не спешили назвать чёрный налёт
на стекле, который даже нельзя было взвесить, новым элементом. Одной
радиоактивности было мало. Коллега и друг супругов Кюри французский химик
Эжен Анатоль Демарсе (1852–1903), специалист в области спектрального
анализа (в 1901 году он открыл европий), исследовал спектр испускания
чёрного налёта и не обнаружил в нём новых линий, которые
могли бы свидетельствовать о присутствии нового элемента.
Спектральный анализ — один из самых чувствительных методов, значит,
в налёте этого вещества было очень мало. Тем не менее
в статье, опубликованной 18 июля 1898 года, супруги Кюри
написали: „Мы думаем, что вещество, выделенное нами из урановой
смолки, содержит неизвестный пока металл, являющийся по аналитическим
свойствам аналогом висмута. Если существование нового металла будет
подтверждено, мы предлагаем назвать его полонием, по родине одного
из нас“ (Polonia на латыни — Польша). Это единственный
случай, когда ещё не идентифицированный новый химический элемент уже
получил название! „Полоний“ — не первое „географическое“ название
элемента. К тому времени уже были открыты и германий, и рутений,
и галлий, и скандий. Тем не менее это название особое, его
можно рассматривать как название-протест: самостоятельного польского
государства в то время не существовало, Польша была раздроблена,
поделена между Австрийской, Германской и Российской империями…
Однако выделить весомые количества полония
превооткрыватели смогли не сразу — его в урановой руде было
слишком мало. Лишь в 1910 году, переработав много урановой руды,
удалось получить образец, содержащий 0,1 мг полония.
Но прославило супругов Кюри открытие не этого элемента, а радия.
Изотопы полония и их
излучение. Для полония известно 35 изотопов (включая восемь ядерных изомеров)
с массовыми числами от 192 до 218, и все они радиоактивны
с периодами полураспада (t1/2
) от3×10 –7 секунды для 212Po до 102 лет
для 209Po. Из них семь (с массовыми числами от 210 до
218) встречаются в природе в очень малых количествах как члены
радиоактивных рядов тория, урана-радия и урана-актиния. Они имеют свои
исторические названия, принятые ещё в начале XX века,когда эти
радионуклиды получали в результате цепочки распадов
из „родительского“ элемента — радия, тория или актиния: RaA (
2l8Po), RaC'( 214Po), RaF ( 210Po), ThA ( 216Po),
ThC' ( 212Po), АсА ( 215Po) и АсС' ( 211Po).
Эти названия до сих пор можно встретить в книгах.
Все остальные изотопы полония получены только искусственно. Наиболее
долгоживущие изотопы полония — 209Po, 208Po и 210Po.
Их периоды полураспада составляют соответственно 102 года, 2,9 года
и 138,4 суток. Иначе говоря, от полония-210 через 4,5 месяца
останется лишь половина, через 14 месяцев — около 10%, через
2 года — менее 3%, через 3 года — 0,4%, через 4 года — всего
0,1%.
Лёгкие изотопы полония — чистые альфа-излучатели.
Это означает, что при их распаде из ядра вылетают
с огромной скоростью α-частицы (ядра гелия) с энергией от 6 до 7
МэВ (для сравнения: энергия самой прочной химической связи в миллион раз
меньше). При α-распаде масса ядра уменьшается на четыре единицы,
а заряд ядра — на две (смещение на две клетки Периодической
таблицы влево). Начиная с 198Po к α-распаду добавляется
электронный захват (иначе — K-захват), при котором электрон с самой
внутренней электронной оболочки атома (K-оболочки) попадает в ядро.
При этом один протон превращается в нейтрон, масса ядра
не меняется, а заряд уменьшается на единицу (смещение
на одну клетку влево). Например, 198Po
на 70% распадается с испусканием α-частиц: 198Po
→ 194Pb + 4Не, а на 30% — путём K-захвата: 198Po
→ 198Bi. И 194Pb, и 198Bi неустойчивы
и быстро распадаются.
Начиная с нуклида 199Po, распад
сопровождается γ-излучением, энергия которого может составлять от 0,17 до
2,6 МэВ, причём данный нуклид способен испускать γ-лучи разной энергии.
Два тяжёлых изотопа полония, 215Po и 218Po, в небольшой
степени обладают также β-активностью. При β-распаде нейтрон
в ядре превращается в протон и электрон, который и вылетает
из ядра. При этом массовое число атома остаётся неизменным,
а заряд увеличивается на единицу (смещение на одну клетку вправо).
Более 99% самого тяжёлого изотопа идут по пути α-распада и
только 0,018% — по пути β-распада: 218Po → 218At
+ е –.
Действие проникающей радиации на биообъекты сильно
зависит от её интенсивности и типа (так, α-частицы намного
опаснее β-частиц при той же дозе). Для нуклида 210Po
почти 100% излучения приходится на α-частицы с энергией
5,3 МэВ. Такие частицы проходят в воздухе 3,8 см,
но их полностью задерживает алюминиевая фольга толщиной 0,03 мм
и даже листок бумаги; а в биологических тканях они проходят менее
0,05 мм, разрушая при этом соседние клетки. При распаде 210Po
возникает и γ-излучение с энергией 0,8 МэВ и большой
проникающей способностью. Чтобы ослабить его в десять раз, требуется уже
трёхсантиметровый слой свинца, а для стократного ослабления понадобится
свинцовая плита толщиной 5,5 см или полуметровый слой бетона. Однако
γ-излучение 210Po очень слабое: его интенсивность составляет
всего лишь 0,0011% от общей радиации.
Малый пробег α-частиц в веществе делает
обнаружение микроколичеств полония-210 трудной задачей. Даже если этот нуклид
находится на поверхности какого-либо предмета, его сможет обнаружить
не всякий счётчик Гейгера, потому что α-частицы задерживаются даже
очень тонкой фольгой. Для обнаружения 210Po можно провести
анализ с помощью сцинтилляционного счетчика. Сцинтилляция (от лат. scintillatio —
сверкание) — слабая вспышка света, возникающая в некоторых веществах под
действием частиц высокой энергии. Другой чувствительный метод
обнаружения — масс-спектрометрия. Он находит в пробах фемтограммы
искомого изотопа.
Радиация есть везде, однако важен её уровень.
Вот пример. Природный калий состоит из трёх изотопов — двух
стабильных (39К — его содержание в природном калии 93,26%
и 41К — 6,73%), а также одного радиоактивного, 40К
(0,012%, период его полураспада 1,3 млрд. лет). Человек, весящий
Полоний в природе. Кларк полония (содержание в земной коре) составляет 2×10
–14%; в извержённых породах его больше. Образуется полоний в результате
радиоактивного распада долгоживущих радиоактивных элементов — тория
и урана. Его изотопы служат промежуточными членами длинных цепочек
распада (так называемых серий или рядов). Сами уран и торий, а также
их соединения в чистом виде практически не представляют
опасности, поскольку распадаются очень медленно — их радиоактивность
мала. Однако при их распаде образуется множество радионуклидов,
которые в сумме дают более интенсивную и более опасную радиацию.
В ряду, который начинается с 232Th (t1/2
= 14 млрд. лет) и заканчивается стабильным изотопом свинца 208Pb,
появляются в качестве шестого и девятого звеньев изотопы
полония 216Po (t1/2 = 0,15 с) и 212Po
(t1/2 = 3×10 –7 с). Очень малое время
жизни этих изотопов означает, что в природе они практически отсутствуют.
Poдоначальник ряда урана-актиния — 235U (t1/2
= 700 млн. лет), а конечный стабильный продукт — 207Pb.
В этом ряду изотопов полония тоже два, и они оба тоже короткоживущие:
215Po (t1/2 = 1,8×10 –3 с) и 211Po
(t1/2 = 0,5 с). Урана-235 в природном уране
всего 0,72%, время жизни 211Po и 215Po мало,
так что этих изотопов в природе тоже практически нет.
Ощутимые количества полония способны накопиться только
в ряду урана-радия, родоначальник которого — 238U,
а конечный продукт — 206Pb. Поэтому природный полоний
представлен практически одним нуклидом 210Po. Среди членов этого
ряда есть не только 210Po (и ещё два его изотопа),
но также очень важные радионуклиды 226Ra и 222Rn.
Один и тот же радионуклид может распадаться по двум
направлениям, которые потом „сходятся“, приводя к одному продукту. Чаще
всего одно из направлений распада значительно преобладает. Например, 218Po
на 99,92% претерпевает α-распад и лишь на 0,02% — β-распад
с образованием изотопа астата 218At; 210Bi, помимо
показанного на схеме β-распада, претерпевает также α-распад
с образованием изотопа таллия 206Tl — но лишь на
1,3×10 –4%. Над каждой стрелкой приведены время
полупревращения нуклида и тип распада.
Прежде чем перейти к герою повествования —
полонию-210, несколько слов о его предшественнике — радоне.
Это благородный газ, поэтому он постепенно, не вступая
в химические реакции, просачивается из глубин земного шара
к поверхности (в разных географических районах — в разных
количествах) и попадает в воздух. На него приходится значительная
часть дозы облучения, которую получает „средний“ человек (в некоторых регионах
— до 50%). Основная часть радона, попавшая при вдохе в трахею, бронхи
и лёгкие, при выдохе выделяется обратно. Однако успевший образоваться
из радона полоний-210 оседает в носоглотке, трахеобронхиальной
и лёгочной областях, откуда через лимфу либо кровеносную систему
разносится по всему организму. Радон хорошо растворяется в воде (в 22
раза лучше, чем азот), поэтому часть радона, попавшая в лёгкие
при вдохе, может проникнуть через стенки лёгочных альвеол, раствориться
в крови и затем распасться с образованием полония. Принято
говорить, что полоний-210 может попасть в лёгкие и с твёрдыми
частицами табачного дыма, на которых он оседает при распаде
радона. Однако вряд ли попавшие таким образом в организм единичные
атомы полония представляют для него опасность, хотя бы
по сравнению с радоном, которого вокруг нас неизмеримо больше.
Вернёмся к ряду радиоактивных превращений урана-238.
Этот изотоп распадается очень медленно — в течение многих миллиардов
лет, что сопоставимо с возрастом Земли. Конечным продуктом распада служит
нерадиоактивный свинец-206. Если атомы урана будут находиться в земной
коре в составе того или иного минерала достаточно долго, нескольких
миллионов лет (лимитирующая стадия, как видно из схемы, — распад
долгоживущего 234U), и газообразный радон не будет
из минерала улетучиваться, то наступит стационарное состояние.
Это означает, что каждый член ряда образуется из своих
предшественников точно с такой же скоростью, с которой
распадается сам. При этом его количество в минерале
в течение обозримого времени не меняется. Радиоактивность же
всех членов ряда (общее число распадов атомов данного члена ряда в единицу
времени) будет одинакова: она диктуется количеством имеющегося в минерале
урана и, следовательно, скоростью его распада. Например,
короткоживущий 218Po в больших количествах
проявлял бы исключительно высокую активность (t1/2 = 3
мин), но этого радионуклида в минерале исключительно мало. Поэтому
его радиоактивность будет такой же, как и у долгоживущего 234U:
хотя уран-234 распадается медленно (t1/2 = 245 тысяч лет),
зато его в минерале сравнительно много. Такое состояние для цепочки
превращений радиохимики называют „радиоактивным равновесием“.
Очевидно, что чем меньше период полураспада члена ряда,
тем меньше его будет в смеси. Нетрудно показать, что отношение числа
атомов N материнского элемента (урана-238) и его дочерних атомов
равно отношению их периодов полураспада, то есть, например, N(238U)
: N(226Ra) : N(210Po) = t1/2(U)
: t1/2(Ra) : t1/2(Po) = 4,5×109
: 1,6×103 : 0,38. Сделав небольшую поправку на различие
атомных масс этих нуклидов (238, 226 и 210), легко подсчитать, что
при равновесии на 1 тонну чистого урана в его рудах
приходится примерно 0,34 г радия и около 0,01 мг 210Po
— если весь полоний из тонны урана выделить, получится шарик диаметром
100 мкм. Но эта порошинка ежесекундно излучает 1,7 млрд.
α-частиц. Не удивительно, что хотя Мария Кюри не смогла получить
ощутимые количества полония, ей удалось идентифицировать этот элемент
по его радиоактивности.
Приведённый ряд урана-радия позволяет оценить вероятность
попадания природного полония в организм человека. Причём речь идёт
о людях, не занятых на урановых рудниках
и не работающих с радионуклидами уранового ряда. Среднее
содержание урана в земной коре — 3×10 –4% по массе.
В некоторых минералах уран встречается вместе с кальцием,
а иногда частично замещает его в кристаллической решётке, так как
их ионные радиусы близки. Таким образом, и в известняке, и в доломите,
и в апатите могут содержаться весьма незначительные примеси урана.
Все упомянутые минералы прямо или опосредованно применяются
в сельском хозяйстве. Известняк и доломит — для раскисления
почв, апатит — для получения минеральных удобрений (суперфосфатов).
Таким образом, какие-то количества урана могут попасть на поля,
а оттуда — в сельскохозяйственные растения. Однако
по химическим свойствам элементы этого радиоактивного ряда отличаются друг
от друга очень сильно (вспомним хотя бы, что радон — благородный
газ). Значит, по пути от минерала к пищевому продукту
или табаку уран практически полностью освободится от своих дочерних
элементов, и уж подавно — от радона. И чтобы из него снова
получился полоний-210 нужно ждать очень долго. Поэтому для того, чтобы
этот радионуклид проник в растения, нужно, чтобы он попал
в удобрения независимо от урана, что крайне маловероятно. Кроме того,
период полупревращения 210Po — всего 4,5 месяца, что также
снижает вероятность его попадания с продуктами сельского хозяйства
в организм человека; во всяком случае, радия таким способом
в него должно попасть намного больше.
Как уже упоминалось, на тонну урана в минералах
приходится менее 0,1 мг полония, или 1 атом полония
на 12 млрд. атомов урана. Это даже не иголка в стоге сена,
а иголка в целом поле, заваленном сеном! Значит, в растение,
выросшее на почве, куда с удобрениями попало немного урана, могут
попасть в худшем (для нас) случае, вероятно, уже не микро-, а фемто-
или даже аттограммы (1 аг = 10 –18 г) полония, и пока продукты
дойдут до потребителя, от них ничего не останется. Можно сделать
и другую оценку. В книге Дж. Эмсли „Элементы“ сказано, что
в организме среднего человека содержится 0,1 мг урана. Значит,
если бы между ним и 210Po сохранялось радиоактивное
равновесие, в человеке полония было бы в 1010 раз
меньше, то есть 10 –11 мг. Но достижение равновесия
лимитируется ураном-234 (с периодом полураспада 250 000 лет). Кроме того,
продукты превращения 238U и других членов ряда постоянно
выводятся из организма. Так что неудивительно, что в упомянутом
справочнике Дж. Эмсли о полонии говорится: „Содержание
в человеческом организме: нулевое“.
Однако возможен другой механизм „отравления“ полонием.
Считается, например, что при курении он попадает в организм
курильщика. Как это может случиться? Вот что говорит об этом
в своём учебнике химии профессор Реймонд Чанг из Массачусетса.
Известно, что при выращивании табака в почву вносят много фосфатных
удобрений. Если в них попадёт один из продуктов распада — радий,
то он в почве будет медленно превращаться в радон. Газообразный радон
концентрируется в почве и в приповерхностном слое воздуха под
воздушным „куполом“, который образован табачными листьями (см. фото). Дочерние
продукты распадающегося радона прочно приклеиваются к поверхности листьев
и проникают в них. Далее они быстро образуют радиоактивный
свинец-210. Постепенно его концентрация достигает довольно высоких значений.
При курении человек вдыхает с дымом мельчайшие твёрдые частицы,
содержащие 210Pb, которые оседают в дыхательных путях,
а затем переносятся в печень, селезёнку и в костный мозг.
Медленно распадаясь, 210Pb превращается в 210Po,
и это происходит в течение всего периода, когда человек курит.
Постоянное облучение упомянутых органов и костного мозга увеличивает
вероятность возникновения рака у курильщика.
Чтобы такой механизм сработал, в удобрение должен
попасть не сам уран, а радий. Возможность этого процесса зависит
от того, какие именно ископаемые были использованы для получения
фосфатных удобрений и какова была технология их переработки.
Получение полония. Полоний (речь идёт только о его изотопе 210Po) можно
получить из природных источников или синтезировать. Первый способ
малопродуктивен, но когда-то он был единственным. При переработке
урановых руд 90% полония остаётся в отвалах гидратированного
кремнезёма, из которого его очень трудно извлечь. Поэтому используют
другой метод: выделяют из руды предыдущие члены радиоактивного ряда
и ждут, пока в них в результате распада накопится достаточно
полония. Так, если выделить значительные количества 210Pb
(этому способствует его большое время жизни), то из него периодически
можно „вылавливать“ 210Po путём отгонки. Когда-то применяли такой
способ: выделяющийся из радия газообразный радон запаивали
в стеклянные ампулы, и после полного его распада (на это требовалось
чуть больше месяца) в них появлялся тот же 210Pb. Можно
отметить в связи с этим, что дочь Марии Кюри Ирэн
в 1925 году защитила докторскую диссертацию, посвящённую
α-излучению полония. Она и её муж Фредерик (в будущем оба — лауреаты
Нобелевской премии по химии) располагали мощным для того времени
полониевым источником α-частиц.
Сейчас 210Po синтезируют путём облучения
нейтронами природного висмута, который содержит только нуклид 209Bi,
в ядерных реакторах (промежуточно образуется (β-активный изотоп
висмута-210): 209Bi + n → 210Bi → 210Po
+ е – (период полураспада 210Bi равен 5
суткам). При этом интенсивность нейтронного потока должна быть
исключительно высокой. Так, если на 1 см2 каждую
секунду будет попадать 500 млрд. нейтронов, то через месяц облучения
в
Первый образец чистого полония был получен только
в марте 1944 года в Дейтоне (штат Огайо). В Poссии методику
выделения полония разработала Зинаида Васильевна Ершова (1905–1995).
В 1937 году она была командирована в Париж, в Институт
радия в лабораторию Марии Кюри (руководимую в то время Ирэн
Жолио-Кюри). После этой командировки коллеги стали называть её „русской
мадам Кюри“. Под научным руководством З.В. Ершовой в СССР было
создано постоянно действующее, экологически чистое производство полония, что
позволило также реализовать программу запуска луноходов, в которых полоний
использовали как источник тепла.
Полоний-210 — предпоследний перед свинцом член
радиоактивного ряда урана — радия. Зная его период полураспада, нетрудно
подсчитать, что каждые сутки распадается примерно 0,5% полония
и образуется столько же свинца. Если с образцом полония после
его синтеза не проводили никаких манипуляций, то, проанализировав
этот образец на содержание полония и свинца, можно определить, как
давно этот образец был получен. Например, через 4,5 месяца число атомов
полония и свинца в образце сравняются, через 9 месяцев свинца
будет уже втрое больше и т. д.
Для получения более долгоживущих изотопов 208Po
и 209Po можно использовать ядерные реакции 207Pb +
α → 208Po + 3n, 209Bi + р →
208Po + 2n, 209Bi + d → 208Po
+ Зn, 209Bi + р → 209Po + n,
209Bi + d → 208Po + 2n, где d —
ускоренные дейтроны (ядра дейтерия), облучение природного висмута проводят
в циклотроне. Все эти методы позволяют получить лишь ничтожные количества
208Po и 209Po, достаточные только для изучения
их радиоактивных свойств.
Свойства полония. Полоний — один из самых опасных радиоэлементов. Эксперименты
с ним требуют соблюдения строжайших мер безопасности. Исследователь должен
быть надёжно защищён от попадания даже малейших следов этого элемента
в дыхательные пути, в пищеварительный тракт. Недопустим также контакт
полония или его химических соединений с кожей. Несмотря на все
эти трудности, физические и химические свойства полония и его
соединений изучены. Полоний — мягкий серебристо-серый металл, похожий
на свинец, с температурой плавления 254°С. Это тяжёлый металл,
его плотность близка к 9,5 г/см3 — больше, чем у меди,
но меньше, чем у серебра. Кстати, плотность полония определена
не непосредственным измерением, а путём рентгенографического
определения параметров кристаллической решётки. Это — следствие высокой
радиоактивности: она не позволяет получать значительные количества
компактного металла, плотность которого можно было бы определить
непосредственно. Непрерывная бомбардировка α-частицами собственной
кристаллической решётки полония приводит к тому, что каждый её атом
в среднем раз в сутки меняет своё место. Это делает
рентгенограммы полония размытыми и затрудняет их расшифровку.
Тем не менее исследователи сумели установить, что существуют две
кристаллические модификации полония. Низкотемпературная кубическая модификация
(её плотность 9,496) при нагревании выше 36°С переходит
в гексагональную (плотность 9,398).
Известно, что препараты радия (t1/2 =
1600 лет) у Марии Кюри светились в темноте. Что уж говорить
о полонии-210! Он не только светится, но и очень сильно
нагревается за счёт поглощения собственных α-частиц, несущих огромную
энергию. Ведь при равных массах полоний в 4500 раз активнее
радия. Кусочек полония размером с напёрсток выделяет около 2 кВт
тепловой энергии. Огромное тепловыделение помогает определять количества
полония-210 по скорости выделения теплоты, но этот способ удобен,
если полония достаточно много — более 0,1 мг.
Если получить весомые количества полония, от них
необходимо непрерывно отводить теплоту, иначе полоний расплавится, а затем
испарится. Но даже когда от образца эффективно отводят тепло,
от его поверхности отрываются микрочастицы металла. Поэтому металлический
полоний легко образует в воздухе мельчайшие частицы аэрозоля, что резко
увеличивает опасность работы с ним. Этот эффект типичен для сильно
радиоактивных металлов и объясняется быстрым накоплением на них
отрицательных зарядов при вылете в воздух положительно заряженных
α-частиц. Кроме того, осевшие на мельчайших частицах пыли атомы
полония в результате механической отдачи при вылете α-частиц
приводят к тому, что такие пылинки совершают „прыжки“ и потому
способны отрываться от поверхностей, на которые они осели.
Полоний кипит при сравнительно невысокой температуре
— 949°С, и это определяет его летучесть (для сравнения: температура
кипения свинца — 1710°С, олова — 2360°С). В парах полоний находится
в виде молекул Po2. Летучесть полония облегчает его
очистку, а также перемещение микроколичеств металла из одной части
аппаратуры в другую путём их нагрева и охлаждения. При 25°С
с 1 см2 поверхности металла испаряется в секунду
более 100 млн. атомов, создавая в замкнутом объёме давление пара 10
–11 мм рт. ст. А вблизи температуры плавления с той же
поверхности за 1 секунду испаряется уже 1017 атомов
полония, создавая смертельное для человека давление паров 10 –3
мм рт. ст. При таком давлении в литре воздухе содержится 6,4 мкг
полония, а смертельная доза составляет порядка 0,1 — 0,2 мкг. Так что
с ощутимыми количествами полония работать трудно.
Для изучения химических свойств полония применяется
только его изотоп 210Po. Более долгоживущие изотопы
для этой цели не используются: получить их трудно,
а химические свойства одинаковы. По химическим свойствам полоний
несколько похож на висмут, а также на свой ближайший
аналог — неметалл теллур, и проявляет типичные для элемента
VI группы степени окисления –2, +2, +4, +6.
На воздухе полоний медленно окисляется (быстро — при нагревании до 250°С)
с образованием красного диоксида PoO2. При охлаждении
до комнатной температуры этот оксид становится жёлтым из-за перестройки
кристаллической решётки. Сероводород из растворов солей полония осаждает
чёрный сульфид PoS. Сульфат полония Po(SO4)2 белого цвета.
В разбавленной соляной кислоте полоний медленно
растворяется, образуя розовые растворы (цвет ионов Po2+):
Po + 2HCl → PoCl2 + Н2, однако под действием
собственной радиации дихлорид превращается в жёлтый тетрахлорид PoCl4.
Разбавленная азотная кислота пассивирует полоний, а концентрированная
быстро его растворяет. С неметаллами VI группы полоний роднят реакция
с водородом, при которой образуется летучий гидрид PoН2
(т. пл. –35°С, т. кип. +35°С, легко разлагается), реакция с металлами (при
нагревании) с образованием твёрдых полонидов черного цвета (Na2Po,
Ag2Po, BePo, MgPo, CaPo, ZnPo, HgPo, PbPo, NiPo, PtPo)
и реакция с расплавленными щелочами с образованием полонидов
и солей полониевой кислоты: 3Po + 6NaOH → 2Na2Po + Na2PoO3
+ Н2O. С хлором полоний реагирует при нагревании, образуя
ярко-жёлтые кристаллы PoCl4, с бромом получаются красные
кристаллы PoBr4, с иодом уже при 40°С — чёрный летучий
иодид PoI4. Известен и белый тетрафторид полония PoF4.
При нагревании тетрагалогениды разлагаются с образованием более
стабильных дигалогенидов — рубиново-красного PoCl2 и
фиолетово-коричневого PoBr2. Известны комплексные галогениды,
например (NH4)2PoBr6. В растворах полоний
существует в виде катионов Po2+, Po4+,
анионов PoO32–, PoO42–, а также
разнообразных комплексных ионов, например PoCl62–.
Сильная радиоактивность полония отражается
на свойствах его соединений, которые почти все очень быстро разлагаются.
Так, практически невозможно получить полониевые соли органических кислот:
они обугливаются уже в момент синтеза. Из иодата полония быстро
выделяется свободный иод, из аммиачных комплексов галогенидов —
свободный металл (восстановителем здесь служит атомарный водород, который
образуется при разложении молекул аммиака под воздействием радиации).
Из водных растворов соединений полония медленно выделяются пузырьки газа,
а в растворе образуется перекись водорода. И даже
в стеклянной посуде с сухим соединением полония из-за
α-облучения уже через несколько дней появляются заметные трещины —
в тех местах, где вещество соприкасалось со стеклом. Такие
стеклянные сосуды становятся очень хрупкими. Если соединение полония содержало
воду, она разлагается на кислород и водород, которые
в герметичной ампуле повышают давление. Оно повышается также из-за непрерывно
образующегося гелия. В результате маленькая ампулка с полонием уже
через неделю может взорваться.
Полоний при попадании в организм можно считать
одним из самых ядовитых веществ: для 210Po предельно
допустимая концентрация (ПДК) в воздухе составляет количество, при котором
за 1 с в
Полоний-210 получил широкую известность в конце 2006
года, когда от отравления этим изотопом в Лондоне скончался перебежчик
Александр Литвиненко
Применение полония. Применение находит только 210Po, его более долгоживущие
изотопы практически недоступны. Удобное время жизни 210Po
позволяет использовать его как источник энергии в атомных батареях
космических кораблей. В этом отношении он превосходит другие
компактные „атомные“ источники энергии. Такой источник энергии работал,
например, на „Луноходе-2“, обогревая аппаратуру во время долгой лунной
ночи, когда за бортом было минус 130°С. Полоний может давать
не только тепло, но и электроэнергию. Для этого
в контейнер с полонием (как правило, используют не чистый
металл, а его сплав со свинцом) помещают горячие спаи термопар, тогда как
холодные спаи находятся снаружи. Мощность полониевых источников энергии
со временем убывает — вдвое каждые 4,5 месяца. Свойство полония
ионизировать воздух в очень ограниченных масштабах используют
для снятия электростатических зарядов.
Полоний удобно применять для исследования
воздействия α-излучения на различные вещества. Как α-излучатель
полоний в виде сплава с бериллием применяют для изготовления
удобных источников нейтронов: 9Ве + 4Не → 12С
+ n. Эти компактные источники удобны для определения состава
различных материалов (нейтронно-активационный анализ). Но есть
у таких источников и другое применение. Так, сообщалось, что
в 2004 году инспекторы Международного агентства по атомной
энергии (МАГАТЭ) обнаружили в Иране программу по производству
полония. Этот привело к подозрению, что он может быть использован
для „запуска“ с помощью нейтронов цепной ядерной реакции
в уране, приводящей к ядерному взрыву.
Неожиданное применение нашёл полоний-210
в криминалистике для обнаружения мастерски сделанных подделок картин
старинных мастеров. Такая датировка основана на измерении радиоактивности
свинцовых белил. Для художников свинцовые белила в течение многих
столетий были одним из наиболее важных пигментов (в настоящее время из-за
ядовитости соединений свинца используют цинковые и титановые белила).
Белила получали из свинцовых руд, которые всегда содержат радиоактивный
уран. Один из промежуточных продуктов распада — радионуклид 210Pb.
Идея метода проста. Пока свинец находится в составе
руды, происходит как распад 210Pb, так и его непрерывное
образование. Поэтому в течение многих тысячелетий его содержание
в руде остаётся постоянным. Но при переработке руды свинец отделяют
от других элементов. С этого момента образование 210Pb
уже не поддерживается предшествующими радиоактивными элементами, поэтому
его содержание, а следовательно, и радиоактивность с годами
снижаются. Это позволяет датировать время изготовления белил, вернее,
время выделения свинца из руды. В этом смысле анализ по свинцу
напоминает известный метод радиоуглеродной датировки древних объектов по углероду-14.
В случае свинца дело осложняется тем, что неизвестно,
сколько было 210Pb в конкретной руде в момент
её переработки. Поэтому простое определение остаточного количества 210Pb
в белилах мало что даёт, и используется другая методика. Суть её
в следующем. При химической переработке руды для извлечения
из неё свинца значительная часть других элементов бывает удалена.
Значительная — но не вся; например, радий очень трудно отделить
от свинца полностью (с этим сталкивалась и Мария Кюри),
и в свинце всегда остаются очень малые его количества. В любом
случае после извлечения из руды свинца радиоактивное равновесие
нарушается: образование 210Pb уже не „поддерживается“
малыми количествами радия в нём, так что скорость распада свинца
становится значительно больше, чем у радия. Но по прошествии
многих десятилетий баланс радий/свинец постепенно будет восстанавливаться, так
что лет через 150 — 200 скорость распада этих нуклидов снова станет одинаковой
(хотя и значительно меньшей, чем в исходной руде). Этим фактом
и можно воспользоваться, чтобы определить, давно ли был добыт свинец.
Сделать это можно только с помощью очень чувствительных и небольших
по размерам твёрдотельных детекторов излучения, регистрирующих
не только интенсивность, но и энергию частиц
и, следовательно, позволяющих отличить одни радионуклиды от других.
Однако по чисто техническим причинам вместо измерения активности 210Pb
измеряют равную ему активность 210Po. Поэтому на практике
измеряют соотношение активностей 226Ra и 210Po
Этот метод был применён в 1967 году
американским исследователем Бернардом Кейшем с сотрудниками. Измерения
подтвердили, что в художественных свинцовых белилах, изготовленных
в разных странах в XX веке, активность 210Po (а
следовательно, и 210Pb) была намного больше, чем радия. Когда
удалось достать образцы белил, изготовленных в Англии, Франции и США
в XIX веке,оказалось, что активность полония в них также
превышает активность радия, хотя уже не так сильно. Наконец,
для образцов из XVIII века активности обоих радионуклидов были
примерно одинаковыми. Таким способом было доказано, что некоторые картины
„старых мастеров“, которые до этого считались подлинными, на самом
деле — подделки.
Другие долгоживущие изотопы полония пока не получили
заметного практического применения из-за сложности их синтеза.
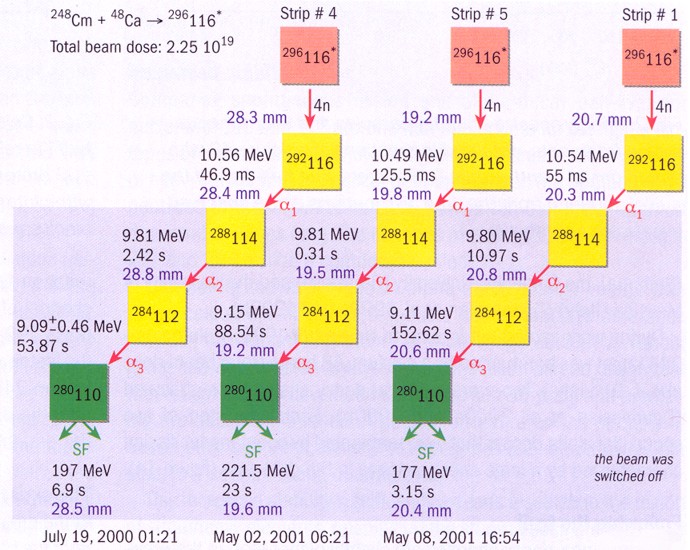 Ливерморий. Химический аналог полония – элемент с атомным номером
116 – был открыт в 2000 году Лаборатории ядерных реакций (ЛЯР) Объединенного
института ядерных исследований в Дубне под руководством Ю.Ц.Оганесяна. В качестве мишени
использовался не менее уникальный изотоп кюрий-248, необходимое количество
которого было наработано в России (НИИАР Димитровград). Опыт тоже оказался
результативным - было зафиксировано 3 атома 116-го элемента При этом при
распаде 292116 воспроизвелась вся цепочка распадов, наблюдаемая нами
при регистрации 288114. Конечно, это был успех и в определенной
степени научное везение. Достоверность полученных результатов не вызывала
сомнений, и в декабре 2001-го лаборатория направила в международный Союз чистой
и прикладной химии заявку на открытие 114-го и 116-го элементов.
Ливерморий. Химический аналог полония – элемент с атомным номером
116 – был открыт в 2000 году Лаборатории ядерных реакций (ЛЯР) Объединенного
института ядерных исследований в Дубне под руководством Ю.Ц.Оганесяна. В качестве мишени
использовался не менее уникальный изотоп кюрий-248, необходимое количество
которого было наработано в России (НИИАР Димитровград). Опыт тоже оказался
результативным - было зафиксировано 3 атома 116-го элемента При этом при
распаде 292116 воспроизвелась вся цепочка распадов, наблюдаемая нами
при регистрации 288114. Конечно, это был успех и в определенной
степени научное везение. Достоверность полученных результатов не вызывала
сомнений, и в декабре 2001-го лаборатория направила в международный Союз чистой
и прикладной химии заявку на открытие 114-го и 116-го элементов.
По состоянию на
июль 2007 года известны изотопы 290, 291, 292 и 293 116-го элемента,
распадающиеся преимущественно путем альфа-распада. Их период полураспада не
превышает 60 миллисекунд (0,06 секунды). В связи с таким кратким временем жизни
в природе эти изотопы не обнаружены, а в лабораториях пока синтезируются в виде
единичных атомов, а не в весовых количествах. Поэтому о практическом применении
данного элемента пока речи не идет. Вероятно, изотопы с массой, соответствующей
«магическому» числу – 184 нейтрона – и соответственно массой ядра около 300 –
могут быть значительно более устойчивы и могут быть использованы в
энергетических целях. Но их получение – это еще дело будущего.
В 2012 году
Международный союз по чистой и прикладной химии (IUPAC) утвердил для данного элемента название «ливерморий» в честь
Ливерморской национальной лаборатории в США, сотрудники которой принимали
участие в экспериментах по синтезу данного элемента в Дубне.