ПРИЛОЖЕНИЕ
В процессе биологической эволюции список элементов, необходимых для живых организмов, непрерывно изменялся и продолжает изменяться в связи с изменением химического состава окружающей среды и необходимостью приспосабливаться к изменяющейся среде.
|
Химический элемент |
норма (мг/кг) |
|
Кобальт |
5-30 |
|
Медь |
10-60 |
|
Марганец |
400-3000 |
|
Цинк |
80-70 |
|
Молибден |
1,5-* |
В пребиотический период (то есть до зарождения первых организмов) в атмосфере планеты практически не было кислорода. Когда появились сине-зеленые водоросли и начался фотосинтез, по ходу которого в атмосферу стал выделяться свободный кислород, организмы начали создавать защитные системы против этого непривычного для них, “токсичного” элемента. Затем появились аэробные организмы, более высокие по своей организации, потребляющие кислород в качестве окислителя при производстве энергии.
Для создания первых живых организмов природа, по всей вероятности, использовала магний, кальций и натрий, а также двухвалентное железо и одновалентную медь. Когда в атмосфере появился кислород, железо на земной поверхности стало переходить в трехвалентное состояние, а медь — в двухвалентное. С развитием геологических процессов постепенно менялся ассортимент соединений металлов на суше, усложнялся состав воды в океанах и морях. Одновременно усложнялась и организация живых систем, в их состав включались новые элементы, выполняющие более сложные биохимические функции. Многие элементы, против которых организмы прежде создавали защитные системы, становились необходимыми для нормальной
жизнедеятельности.Это рассуждение делает более понятным тот факт, что для каждого биологически активного микроэлемента существует нижняя пороговая концентрация в окружающей среде, ниже которой из-за недостатка этого элемента нарушается нормальная жизнедеятельность человеческого организма, и высшая пороговая концентрация, выше которой в силу своего избытка элемент также нарушает нормальную жизнедеятельность.
Необходимые микроэлементы человек получает с водой, с животной и растительной пищей, животные в конечном счете получают их из растений, а те — из почвы. Вот почему избыток или недостаток микроэлементов в почвах некоторой местности влечет за собой болезни живущих там людей и животных. Недостаток цинка обусловливает карликовый рост животных, избытон молибдена — подагру у человека, ненормальная концентрация марганца, как избыточная, так и недостаточная, приводит к заболеваниям костной системы, ненормальная концентрация меди — к анемии и т. д.
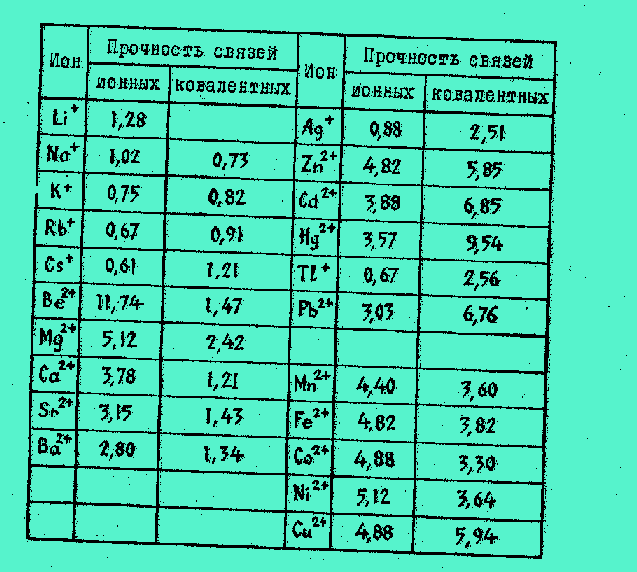
Химическая связь между двумя атомами — это пара общих для них электронов (если у атомов есть две или три пары общих электронов, то говорят о двойной и тройной связи).
Бывает так, что эта пара почти полностью смещается к одному из связанных ею атомов и он в силу этого приобретает отрицательный заряд, а другой атом — положительный. 0 таком случае говорят об ионной связи, ее можно истолковать как электростатическое притяжение двух ионов. При* мером здесь может послужить молекула поваренной соли: можно сказать, что она состоит из положительно заряженного иона натрия и отрицательно заряженного иона хлора.
Если же смещения не происходит, говорят о ковалентной связи. Пример — молекула водорода, состоящая из двух атомов этого элемента. Поскольку они одинаковы, не имеет смысла говорить о смещении связующей электронной пары к одному из них.
Способность иона к образованию ионной связи естественно оценивать характеристикой, сходной по форме е выражением силы взаимодействия зарядов в законе Кулона. Опыт подтвердил применимость такой формулы, где в числителе стоит квадрат заряда иона, а в знаменателе — его радиус. На основании этой формулы заполнен первый
столбец таблицы.Атом превращается в ион, теряя электроны с внешней электронной оболочки. Очевидно, энергия, которую необходимо затратить для удаления этих электронов (ее называют потенциалом ионизации), может послужить оценкой силы, с которой ион будет удерживать электроны, которые примет, вступая в ковалентную связь. Следует учесть при этом, что биохимические реакции протекают в водной среде, а в ней ионы обычно гидратированы, то есть окружены молекулами воды, которые следует удалить,
чтобы ионы могли вступать в химическую связь (необходимую для этого энергию называют теплотой гидратации). Поэтому способность иона и образованию ковалентной связи естественно оценить разностью потенциала ионизации и теплоты гидратации. Эксперимент подтверждает применимость этой формулы. Согласно ей заполнен второй столбец таблицы.Прочность связей выражена в условных единицах
.